




COVID-19 - Vaccins
Dispositif de surveillance renforcée des vaccins
Mise à jour le 04/02/2021
La surveillance des vaccins contre la COVID-19 sera un enjeu majeur pour garantir notamment leur efficacité dans la population ainsi que pour identifier les éventuels effets indésirables qui n’auraient pas été observés lors des essais cliniques.
En effet, au moment de la mise sur le marché, l’ensemble des effets indésirables liés à un médicament ne sont pas toujours connus, en particulier les effets rares (<1/1000) ou retardés. C’est pourquoi, lorsque le médicament arrive sur le marché et devient disponible pour un plus grand nombre de personnes, il continue à être suivi et analysé en permanence compte tenu de l’évolution des connaissances et de son utilisation dans la vie quotidienne.
L’ANSM évalue la sécurité d’emploi des vaccins en assurant une surveillance continue des effets indésirables (ou effets secondaires) prévisibles ou inattendus.
| Cette surveillance repose notamment sur :
|
Dans le cadre de la campagne nationale de vaccination contre la COVID-19, l’ANSM met en place un dispositif spécifique de surveillance renforcée des effets indésirables des vaccins anti-Covid-19 sur le territoire français. Ce dispositif s’intègre dans le plan de gestion des risques coordonné par l’Agence Européenne du Médicament (EMA).
Les objectifs sont de réaliser une évaluation continue de la sécurité des vaccins contre la Covid-19 afin d‘être en capacité de s’assurer de leur innocuité ou de prendre rapidement les mesures qui s’imposeraient, et de permettre au Ministère chargé de la Santé d’adapter la stratégie de vaccination, si nécessaire.
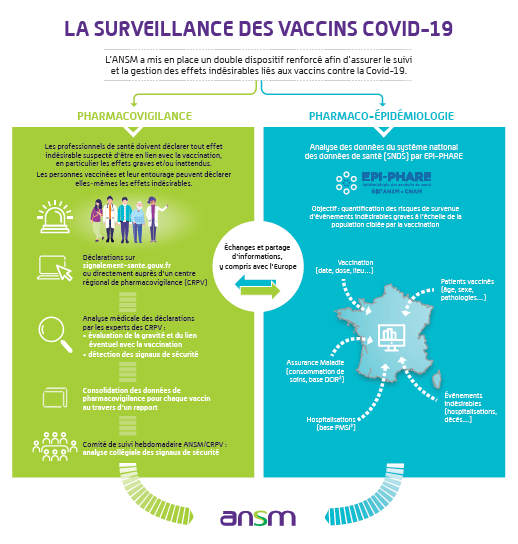
Déclaration des effets indésirables et surveillance des signaux
Les professionnels de santé ou les usagers peuvent signaler sur le site signalement-sante.gouv.fr tout effet indésirable immédiat ou retardé à la suite d’une vaccination. Le formulaire de signalement sera adapté afin de recueillir des données supplémentaires relatives aux vaccins COVID-19 lors de la déclaration des effets indésirables.
Pour faciliter la déclaration, en particulier celle des effets indésirables graves et/ou inattendus, l’ANSM met à la disposition des professionnels de santé, des personnes vaccinées et de leur entourage, des guides rappelant le principe de la démarche et la marche à suivre.
 signalement.social-sante.gouv |
Enquête de pharmacovigilance au niveau national
L’ANSM a mobilisé le réseau des centres régionaux de pharmacovigilance (CRPV) pour assurer une surveillance continue des effets indésirables liés aux vaccins COVID-19.
Une enquête de pharmacovigilance sera mise en place avec l’implication de plusieurs centres régionaux sur le territoire national. Cette mobilisation exceptionnelle permettra de surveiller en temps réel le profil de sécurité des vaccins chez la population vaccinée à partir des déclarations réalisées.
Si un signal de sécurité est identifié, il sera analysé collégialement dans le cadre d’un comité de suivi hebdomadaire mis en place par l’ANSM notamment avec les centres de pharmacovigilance. Un croisement des signaux, notamment émanant des essais cliniques, de la veille documentaire scientifique et de la veille statistique de la base nationale de pharmacovigilance, est également réalisé et discuté dans le cadre de ce comité.
Si un signal de sécurité est validé, des mesures adaptées à la nature du risque seront mises en place. Ces mesures auront pour objectifs de prévenir ou réduire la probabilité de survenue du risque chez les personnes vaccinées.
L’ANSM publie, chaque semaine à l’issue du comité suivi, le rapport de pharmacovigilance et une fiche synthétique intégrant les chiffres clés des données de pharmacovigilance (BNPV) et les résultats marquants sur son site Internet.
Traitement des signalements de pharmacovigilance à l’aide de l’intelligence artificielle
Actualisé le 15/01/2021
Afin de rendre plus rapide le traitement par les CRPV des déclarations d’effets indésirables susceptibles d’être liés à la vaccination, l’ANSM a mis en place un module fondé sur l’intelligence artificielle (IA) qui intègre les techniques de Machine Learning (apprentissage statistique).
Ce module s’appuie sur les informations saisies dans le portail des signalements et permet une analyse automatisée préalable des déclarations d’effets indésirables afin de les catégoriser plus rapidement, notamment en fonction du type d’effet indésirable et de sa gravité.
Il a été expérimenté avec succès au niveau régional et généralisé à l’ensemble des CRPV français début 2021.
Le module ne réalise pas d’analyse médicale, qui est toujours effectuée par le CRPV avant un enregistrement dans la base nationale de pharmacovigilance (BNPV).
Ce système, dont la mise en œuvre est assurée par la société française Synapse dans le cadre d’un marché public, répond au cahier des charges élaboré selon les exigences de l’ANSSI (Agence nationale de sécurité des systèmes d’information en termes de sécurité) en matière de sécurité des données. Seules les données pseudononymisées seront stockées par Synapse sur des serveurs labellisés « Hébergement de Données de Santé » et non soumis au droit états-unien.
Suivi pharmaco-épidémiologique
Dans le cadre du dispositif renforcé de surveillance des vaccins contre la COVID-19, des études pharmaco-épidémiologiques seront réalisées par le Groupement d’Intérêt Scientifique EPI-PHARE (GIS ANSM-CNAM) sur l’ensemble de la population ciblée par la vaccination en France.
Elles seront basées sur les données du Système National des Données de Santé (SNDS) qui fournit des informations individuelles exhaustives sur les consommations de soins (DCIR) et les hospitalisations (PMSI) de la quasi-totalité de la population française. Il s’agira notamment d’informations sur la vaccination (date, dose, lieu de vaccination, etc.), des caractéristiques des personnes vaccinées (âge, sexe, pathologies, etc.), et la survenue d'évènements indésirables graves après la vaccination (par exemple une hospitalisation).
Ce dispositif permettra ainsi de quantifier les risques de survenue d’événements indésirables post-vaccinaux graves, c’est-à-dire pour l’essentiel conduisant à une hospitalisation ou un décès, à l’échelle de l’ensemble de la population ciblée par la vaccination en France.
Des travaux spécifiques ciblés sur des problématiques particulières à certaines catégories de la population seront également mis en place. Cela concernera les personnes âgées et/ou hébergées en EHPAD, les personnes atteintes de comorbidités exposant à un risque accru de forme grave de la COVID-19, les femmes enceintes, les adultes jeunes.
Les informations issues de ces études basées sur une approche populationnelle comparative seront complémentaires de celles obtenues par le système de pharmacovigilance.
Actualisé le 15/01/2021
Fréquence des décès et des hospitalisations parmi les personnes résidant EHPAD ou USLD en France en 2018 et 2019
EPI-PHARE a conduit un premier travail visant à décrire la fréquence des décès et des hospitalisations parmi les personnes résidant en établissement d’hébergement pour personnes âgées dépendantes (EHPAD) ou unité de soin longue durée (USLD) en France au cours des années 2018 et 2019.
Ce travail confirme et quantifie la fréquence élevée des décès et des hospitalisations parmi les résidents des EHPAD et USLD en dehors du contexte de l’épidémie de Covid-19, et il permet d’en estimer les nombres attendus au cours des mois à venir, alors que la campagne de vaccination débute.
Ces chiffres, qui atteignent de l’ordre de 465 décès et plus de 1000 hospitalisations par jour, fournissent une première base de comparaison pour le suivi de la sécurité des vaccins dans cette population, dans l’attente de la mise en œuvre d’études de pharmaco-épidémiologie fines.
Surveillance renforcée nationale et européenne
En cas d’un signal détectée en France ou à l’international susceptible de conduire à une réévaluation du rapport bénéfice-risques des vaccins, les autorités compétentes des Etats membres de la communauté européenne s’informeront mutuellement afin de prendre des dispositions concertées.







 (966 ko)
(966 ko)