




Médicaments génériques
L’inspection
Il existe différents niveaux d’inspection pour les médicaments (dont les génériques) |
Principaux référentiels pour les inspections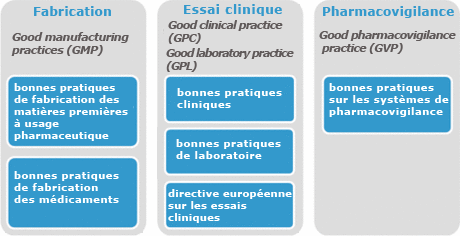 Les référentiels applicables aux médicaments sont tous basés sur la législation européenne |
Que se passe-t-il après une inspection ?
En cas de manquement aux différentes règlementations applicables, l’ANSM peut prendre des injonctions pour que l’opérateur régularise la situation dans un délai déterminé ou des décisions de police sanitaire (décisions de suspension d’activités ou de produits). Elle peut aussi prendre des sanctions financières.
Lire
- Le processus d’inspection
- Bonnes pratiques de fabrication de médicaments à usage humain
- Synthèses des campagnes d'inspection
Les référentiels applicables aux médicaments sont tous basés sur la législation européenne
Lire aussi
- Médicaments génériques à l’usage des professionnels : des médicaments contrôlés (site Ministère des Affaires sociales et de la Santé)
|
|
L'inspection des activités de fabrication (BPF)
Un programme d’inspections sur les lieux de développement et de fabrication de médicaments a été instauré depuis de nombreuses années. Il permet de contrôler la qualité de l’ensemble des médicaments, dont les génériques, de vérifier le respect des bonnes pratiques de fabrication, la conformité des dossiers de lots et des opérations réalisées au dossier d’AMM.
 |
L’ANSM inspecte 90 sites de fabrication de matière première par an
L’ANSM inspecte 200 établissements pharmaceutiques par an
|
|
Coopération internationale
Les inspections confirment une mondialisation des acteurs :
- de la chaîne de production et de distribution des matières premières
- de la chaîne de fabrication et d’exploitation des médicaments (titulaires d’autorisations de mise sur le marché, exploitants, fabricants pour la fabrication totale ou partielle -par exemple, fabrication limitée au conditionnement-, importateurs…), plus particulièrement en Inde, aux USA et en Chine.
La majorité des médicaments génériques (produit fini) dispensés en France est fabriquée en Europe.
La dispersion des opérateurs complexifie leur suivi et leur contrôle (audits des donneurs d'ordre et inspections des autorités compétentes).
La direction de l’inspection de l’ANSM et ses homologues des agences européennes et internationales coordonnent en conséquence leurs actions d’inspections pour optimiser le contrôle de ces activités en pays tiers.
Des inspections conjointes et des échanges concernant la programmation des inspections, organisées en liaison avec l’EMA et l’EDQM (Direction Européenne de la qualité du Médicament) notamment, permettent ainsi de couvrir les sites lointains et d’échanger des informations sur les résultats de ces inspections. Le programme d’inspection coordonné des fabricants de substances actives lancé en 2008 et associant EMA, TGA (Australie), FDA (Etats-Unis) et EDQM a permis l’inspection d’un très grand nombre de sites
L’ANSM est aussi particulièrement impliquée dans la conception de règles et de processus européens et internationaux d'harmonisation des pratiques d’inspection (EMA, PIC/S et ICH plus particulièrement).
Les fabricants de produits finis qui utilisent des substances actives, y compris de pays tiers, doivent s’assurer de la qualité de ces substances actives par des audits du respect des BPF. Les autorités nationales compétentes s’assurent que cette responsabilité est pleinement exercée notamment lors des inspections qu’elles réalisent.
Les exigences vis-à-vis de l’importation de substances actives sont renforcées depuis l’entrée en vigueur en juillet 2013 de la directive n°2011-62 :
une "confirmation écrite" des autorités compétentes du pays d’exportation doit confirmer le respect des BPF, sauf si elles proviennent d’un pays dont le système est reconnu par l’Union européenne.
|
|
L'inspection des essais de bioéquivalence
Les études de bioéquivalence peuvent être réalisées pour des médicaments non génériques (pour une extension de gamme, une nouvelle forme pharmaceutique…) mais la majorité de ces études sont réalisées pour les médicaments génériques.
L’Agence a mis en place, dès 1994, un programme spécifique d’inspections des essais de bioéquivalence pour les médicaments destinés au marché français ou européen.
L’ANSM inspecte entre 10 et 20 essais de bioéquivalence par an.
La qualité et la fiabilité des données des essais de bioéquivalence sont particulièrement importantes.
Seule une infime proportion des essais de bioéquivalence soumis à l'ANSM est réalisée en France.
Une minorité d'essais est réalisée en Europe, principalement en Espagne, en Allemagne et dans des pays d'Europe centrale. La plupart des essais sont réalisés en Amérique du Nord, en Afrique du Sud et en Inde.
Cartographie des régions inspectées (en nombre d’inspection)(Source : rapport d’activité ANSM 2015) |
2012 | 2013 | 2014 | 2015 |
| France | 3 | 1 | 2 | 2 |
| Asie | 15 | 10 | 8 | 3 |
| Autres pays tiers à l’UE | 2 | 0 | 0 | 4 |
Implications de l'ANSM dans la coopération européenne et internationale
L'ANSM propose des actions de formation et d’accompagnement aux inspections aux inspecteurs travaillant à l’étranger.
Elle s’investit dans l’harmonisation des pratiques d’inspection et la coordination des actions avec ses partenaires européens et à l’international, notamment dans le cadre de l’initiative FDA.
Enfin, l’ANSM participe activement à la rédaction des lignes directrices européennes sur la validation des méthodes bioanalytiques utilisées dans les essais de bioéquivalence.
 |
En cas de manquement aux différentes règlementations applicables, l’ANSM peut imposer la mise en conformité des pratiques d’un opérateur. Elle peut prononcer des suspensions d’AMM. Ces suspensions sont levées dès lors que ce qui en est à l’origine a été corrigé.
9 missions d’inspection ont été réalisées en 2015, toutes à l’étranger ; 2 l’ont été dans le cadre d’un dossier de demande d’AMM centralisée.
|
|
Lire aussi
Un Groupe de Travail dédié aux études de bioéquivalence a été créé en 2014 avec la participation des laboratoires pour définir et mettre en œuvre un plan d’action national. Son objectif est d’améliorer la qualité des études de bioéquivalence , en miroir d’un plan d’action européen mené sous l’égide de l’EMA et avec la participation forte de l’ANSM.
L'inspection des activités de pharmacovigilance
L’ANSM inspecte régulièrement la mise en oeuvre des pratiques des entreprises en termes de pharmacovigilance.
Depuis 2007, dans le cadre du renforcement de la surveillance du risque et du bon usage des médicaments, un programme spécifique d’inspections permet de contrôler de façon approfondie les activités de pharmacovigilance.
Chaque année, l’ANSM réalise 10 à 15 inspections spécifiques et renforcées du système de pharmacovigilance des responsables de mise sur le marché ou de leurs exploitants des AMM.
 Les systèmes de pharmacovigilance des établissements exploitant des médicaments génériques ne présentent pas de différences significatives par rapport aux systèmes de pharmacovigilance des autres établissements (tant sur le nombre que sur la nature des défaillances critiques et majeures identifiées). |







