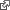Pandémie grippale
Evaluation et production des vaccins pandémiques
Le vaccin est le meilleur moyen de prévention contre les infections et notamment la grippe, en permettant au corps humain de stimuler la production d’anticorps et de l’immuniser contre le virus.
Pour disposer d’un vaccin contre la grippe A (H1N1), deux méthodes sont à l’œuvre :
- L’adaptation d’un vaccin précédemment conçu pour lutter contre la grippe aviaire H5N1
- Le développement d’un vaccin directement à partir de la souche du virus responsable de la pandémie de grippe A (H1N1)
Pour disposer rapidement d’un vaccin pandémique tout en conservant la rigueur scientifique de l’évaluation des données présentées par les laboratoires, l’Agence européenne des médicaments (EMA) a adapté ses procédures d’évaluation pour réduire, dans la mesure du possible, le délai d’attribution des Autorisations de Mise sur le Marché (AMM).
Evaluation
Quatre laboratoires (GSK, Novartis, Baxter et Sanofi Pasteur) ont développé un vaccin contre le virus de la grippe A (H1N1) pandémique en vue de son utilisation en Europe, et d’autres laboratoires ont engagé un tel développement ailleurs dans le monde.
Trois de ces quatre laboratoires (Novartis, GSK, Baxter) l’ont fait sur la base d’un vaccin « mock-up » c’est à dire préparé en avance avec une souche virale H5N1, puis adapté avec la souche du virus H1N1 telle qu’identifiée par l’OMS en mai 2009.
Cette procédure adaptée à un contexte pandémique s’appuie sur l’hypothèse que l’on peut globalement extrapoler le résultat des essais cliniques fait sur la souche du virus H5N1, l’écart de composition entre cette souche grippale et la souche pandémique actuelle (différence d’antigènes) n’étant pas de nature à modifier de façon significative le profil d’efficacité et de sécurité du vaccin compte tenu notamment de la similarité des méthodes de production et de contrôle et du fait que dans les deux cas la population à vacciner n’a pas été antérieurement exposée au virus
Après évaluation de ces données, l’EMA a émis le 25 septembre 2009 un avis positif pour deux vaccins, Pandemrix (Laboratoire GlaxoSmithKline Biologicals) et Focetria (Laboratoire Novartis Vaccines and Diagnostics). La commission européenne a accordé l'autorisation de mise sur le marché pour ces deux vaccins le 29 septembre 2009.
L'EMA a émis le 2 octobre 2009 un avis positif pour le vaccin Celvapan (Laboratoire Baxter).
La Commission Européenne a accordé l'AMM au vaccin Celvapan le 6 octobre 2009.
Dans le cadre d'une procédure commune à plusieurs Etats-membres, l’Agence a accordé le 16 novembre 2009 une autorisation de mise sur le marché au vaccin grippal pandémique Panenza.
Pandemrix®
Panenza ®
Lire aussi
- Vaccin autorisé dans le cadre d'une procédure décentralisée : PANENZA (fiche technique) (16/11/2009)
 (75 ko)
(75 ko)
- Vaccins bénéficiant d’une opinion favorable du CHMP : PANDEMRIX, FOCETRIA et CELVAPAN (16/10/2009)
 (286 ko)
(286 ko)
- Processus d'autorisation de mise sur le marché des vaccins prépandémiques et pandémiques (07/10/2009)
 (65 ko)
(65 ko)
- Informations sur les vaccins Grippe A(H1N1)v pandémiques - questions/réponses (07/10/2009)
 (85 ko)
(85 ko)
- Vaccins grippaux pandémiques A(H1N1)v autorisés selon une procédure de dossier prototype (« Mock-up ») - Note explicative (02/10/2009)
 (154 ko)
(154 ko)
- Risque de confusion possible entre le médicament homéopathique « influenzinum type A 9CH » et les vaccins contre le virus de la grippe A (H1N1)v.
Composition des vaccins
Outre les composés qui permettent l’immunisation contre une maladie (le plus souvent un microorganisme tué ou atténué), un vaccin est constitué d’adjuvants qui en améliorent l’efficacité, d’agents de conservation (dont les sels de mercure appelé aussi thiomersal) et de stabilisants.
Les adjuvants facilitent la présentation des antigènes aux cellules immunocompétentes et renforcent ainsi la réaction immunitaire pour une même dose d’antigène vaccinal. Ils peuvent aussi élargir la protection en cas de mutation du virus. L’adjuvant le plus classiquement utilisé est l’aluminium, en particulier dans les vaccins grippaux saisonniers.
Les adjuvants à base de squalènes
Les vaccins pandémiques avec adjuvant qui viennent d’être autorisés comportent des adjuvants d’une génération plus récente dite huile dans l’eau. Leur composition incorpore essentiellement du squalène (substance lipidique qui est présente notamment dans les aliments). C’est le cas pour les adjuvants MF59 et ASO3.
Les études pré-cliniques réalisées chez plusieurs espèces animales n’ont pas montré de toxicité particulière, notamment de foeto-toxicité, ou de tératogénicité.
Les études cliniques effectuées chez l’homme avec des vaccins comportant ces mêmes adjuvants n’ont pas fait apparaître de signal de risque, hormis une augmentation des réactions locales au point d’injection de type rougeur et douleur.
Enfin, il faut rappeler qu’il existe déjà un vaccin contre la grippe saisonnière contenant un adjuvant à base de squalène, le MF59. Il s’agit du vaccin Gripguard qui est autorisé depuis 2001 en France et a déjà été utilisé très largement (environ 45.000.000 de doses), notamment en Europe. Le suivi de pharmacovigilance n’a pas fait apparaître de problème de tolérance ou de réactions immunologiques anormales.
Un vaccin sans adjuvant a été développé et compléte l’offre de couverture vaccinale d’ici le milieu de l’automne notamment pour vacciner des personnes immunologiquement plus vulnérables, telles que les femmes enceintes, les très jeunes enfants ou les personnes immunodéprimées.
Dans ces cas, le choix d’un vaccin sans adjuvant, tel que préconisé par le Haut Conseil de Santé Publique dans son avis du 7 septembre 2009, le sera à titre de précaution. En effet, les diverses études scientifiques qui ont été conduites en Europe et dans le monde, n’ont pas permis d’établir un lien entre l’utilisation de vaccins avec adjuvants et l’apparition de perturbations du système immunitaire aux conséquences graves dans la période suivant la vaccination.
Il est intéressant de pouvoir disposer des deux types de vaccins, avec et sans adjuvant squalène. En effet, les vaccins avec adjuvant permettent d’utiliser de plus faibles doses d’antigènes et donc de vacciner de plus grandes populations dans un délai très court, sachant qu’il faut plusieurs mois pour produire les vaccins et que cette donnée est importante pour la gestion de la pandémie.
Le thiomersal
Le thiomersal est un composé contenant du mercure qui est utilisé de longue date comme conservateur dans les médicaments, en particulier dans les vaccins. Il contribue à prévenir la contamination bactérienne des vaccins, et il est considéré à ce jour comme l’une des substances les plus efficaces pour cette prévention. Il a été également établi que le thiomersal contribuait à améliorer la stabilité des médicaments.
Ces propriétés sont particulièrement utiles dans le cadre de campagnes de vaccination où des conditionnements multidoses sont utilisés et où les doses ne sont pas administrées de façon immédiate et simultanée à plusieurs patients.
Le thiomersal est actuellement présent dans tous les vaccins contre la grippe, à des doses minimes, c'est-à-dire comprises entre 0,003% et 0,01% (de 25 à 50 microgramme/dose). A ces doses, tout risque de toxicité est a priori exclu.
A la fin des années 90, une préoccupation est apparue, notamment aux Etats-Unis, à partir de l’hypothèse selon laquelle l’exposition précoce au thiomersal pourrait être associée à des déficits neuropsychologiques chez les enfants, ainsi qu’à des atteintes rénales.
Les études scientifiques effectuées pour éprouver cette hypothèse n’ont pas confirmé l’existence d’une association causale entre l’exposition précoce à cette substance et des problèmes neuropsychologiques ultérieurs en phase de pré-adolescence, notamment l’autisme (cf en particulier New England Journal of Medicines 27-09-2007).
Le seul risque identifié est une allergie de contact, liée à la présence de sels de mercure sur la peau.
Lire aussi
- Les adjuvants dans les vaccins pandémiques H1N1 (07/10/2009)
 (66 ko)
(66 ko)
- Vaccins contre le virus de la grippe A(H1N1)v : le thiomersal (07/10/2009)
 (64 ko)
(64 ko)
- Recommandations sur les priorités sanitaires d’utilisation des vaccins pandémiques dirigés contre le virus grippal A(H1N1)v - Haut Conseil de la santé publique (02/10/2009)
 (592 ko)
(592 ko)
Les étapes de production des vaccins
Production des lots de semence caractérisés
La souche vaccinale officielle validée par l’OMS est préparée à partir du virus H1N1 circulant. Cette souche vaccinale permet de fournir les lots de semence caractérisés. Tous les lots de semence sont systématiquement contrôlés avant de pouvoir être utilisés pour la production. Les contrôles réalisés garantissent l’identité de la souche et la sécurité microbiologique.
La production des monovalents peut se faire soit sur œufs soit sur cellules
Production sur œufs
Le virus issu des lots de semence caractérisés est inoculé dans le liquide allantoïque d’œufs embryonnés (œufs issus d’élevage dédiés, reconnus sains). Après une incubation de quelques jours (quatre à cinq jours), le liquide allantoïque contenant les virus est récolté.
OU :
Production sur cellules
Le virus issu des lots de semence est inoculé à une culture cellulaire produite dans un fermenteur. Après incubation et amplification, les cellules sont détruites (= lyse) afin de récupérer le virus. Les cellules utilisées proviennent de cultures sur lesquelles de nombreux tests microbiologies ont été réalisés afin d’en assurer la sécurité.

Inactivation / fragmentation / purification
Les récoltes de virus sont inactivées par le formaldéhyde puis, selon le type de production, les virus peuvent être fragmentés (détergent) et purifiés. A la fin de ces étapes, on obtient ainsi les monovalents.
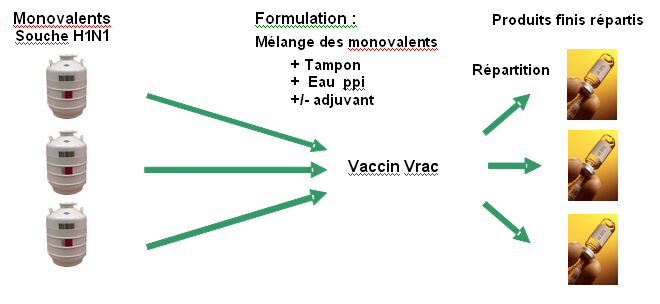
Une fois les monovalents produits la formulation du produit fini peut avoir lieu
Formulation
A ce stade un ou plusieurs monovalents sont mélangés et dilués par du tampon (ex : PBS) et de l’eau pour préparation injectable en présence d’adjuvant. On obtient alors le « vaccin vrac ». Il contient la quantité d’hémagglutinine et d’adjuvant à la concentration définie dans l’AMM.
Répartition/Mise sous forme pharmaceutique
La dernière étape consiste en la répartition aseptique du « vaccin vrac » dans les flacons mono-doses ou multi-doses.
La production d’un vaccin pandémique doit être réalisée dans un laps de temps optimisé. Cependant, il faut un minimum de 12 semaines pour produire les premiers lots d’un vaccin pandémique. Les contrôles en laboratoire réalisés par l’ANSM débutent dès la 7e semaine.
Les contrôles en laboratoire et la libération de lots
Tous les vaccins, qui circulent en Europe, sont contrôlés avant leur mise sur le marché par une autorité nationale indépendante.
Une procédure similaire, qui suit les recommandations techniques de l’OMS, s’applique à ces mêmes produits exportés hors de l’Union Européenne.
Les vaccins sont composés de principes actifs d'origine biologique. Certains systèmes de production font intervenir des organismes vivants (culture sur œufs, sur cellules). Ces procédés de fabrication sont souvent longs et complexes et font l’objet de nombreuses étapes de contrôle pour garantir la qualité de chaque lot et maintenir une bonne régularité de production au cours du temps.
D’autres éléments tels que les faibles dosages en principe actif (microgrammes versus mg ou g), ou la faible fréquence d'utilisation (versus traitements permanents) viennent également renforcer l’intérêt d’un suivi lot par lot sous la responsabilité d’une autorité indépendante du fabricant.
Pour chaque lot produit, les fabricants de vaccins sont tenus de fournir à une autorité de contrôle en Europe, la totalité de leurs données de fabrication et de contrôle (protocole du lot), des échantillons du lot et une demande de libération du lot indiquant sa destination (Europe, agence des nations unies, pays export défini). Au total, le site de Lyon de l’ANSM contrôle et libère près de 40% des lots de vaccins utilisés en Europe et en conséquence 50% des doses de vaccins administrées en France.
Dans le cadre de la lutte contre la pandémie grippale au sein du réseau Européen des laboratoires (OMCL), l’ANSM est identifiée comme l’une des principales autorités assurant le contrôle et la libération en Europe des vaccins pandémiques H1N1. A ce titre, elle est déjà chargée d’assurer le contrôle et la libération des vaccins de Sanofi Pasteur ainsi que d’une partie des lots produits par la société GSK (en collaboration avec l’Allemagne).